RESOLUÇÃO - RDC No- 52, DE 6 DE OUTUBRO DE 2011
Dispõe sobre a proibição do uso das substâncias anfepramona, femproporex e mazindol, seus sais e isômeros, bem como intermediários e medidas de controle da prescrição e dispensação de medicamentos que contenham a substância sibutramina, seus sais e isômeros, bem como intermediários e dá outras providências.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11, inciso IV, do Regulamento da Agência Nacional de Vigilância Sanitária, aprovado pelo Decreto No- 3.029, de 16 de abril de 1999, e tendo em vista o disposto no inciso II e nos §§ 1º e 3º do art. 54 do Regimento Interno aprovado nos termos do Anexo I da Portaria No- 354 da ANVISA, de 11 de agosto
de 2006, republicada no DOU de 21 de agosto de 2006, em reunião realizada em 4 de outubro de 2011, Adota a seguinte Resolução da Diretoria Colegiada e eu, Diretor-Presidente, determino sua publicação:
Art. 1º Fica vedada a fabricação, importação, exportação, distribuição, manipulação, prescrição, dispensação, o aviamento, comércio e uso de medicamentos ou fórmulas medicamentosas que contenham as substâncias anfepramona, femproporex e mazindol, seus sais e isômeros, bem como intermediários.
Art. 2º Fica vedada a prescrição, a dispensação e o aviamento de medicamentos ou fórmulas medicamentosas que contenham a substância sibutramina, seus sais e isômeros, bem como intermediários acima da Dose Diária Recomendada de 15 mg/dia (quinze miligramas por dia).
Parágrafo único. A prescrição, a dispensação e o aviamento de medicamentos ou fórmulas medicamentosas que contenham a sibutramina, respeitada a dosagem máxima estabelecida no caput, deverão ser realizados por meio da Notificação de Receita "B2", de acordo com a Resolução de Diretoria Colegiada - RDC No- 58, de 05 de setembro de 2007, ou a que vier a substituí-la, ficando condicionados às medidas de controle definidas nesta Resolução.
Art. 3° Somente será permitido o aviamento de fórmulas magistrais de medicamentos que contenham a substância sibutramina nos casos em que o prescritor tenha indicado que o medicamento deve ser manipulado, em receituário próprio, na forma do item 5.17 do Anexo da Resolução de Diretoria Colegiada - RDC No- 67, de 08 de outubro de 2007, que dispõe sobre as Boas Práticas de Manipulação de Preparações Magistrais e Oficinais para Uso Humano em farmácias, que deve acompanhar a Notificação de Receita "B2".
Art. 4º A prescrição de que trata o parágrafo único do art. 2º deverá ser acompanhada de Termo de Responsabilidade do Prescritor, conforme modelo constante do Anexo I desta Resolução, a ser preenchido
em três vias, devendo uma via ser arquivada no prontuário do paciente, uma via ser arquivada na farmácia ou drogaria dispensadora e uma via mantida com o paciente.
Parágrafo único. O Termo de Responsabilidade a que se refere o caput deverá ser assinado pelo paciente, a título de confirmação de que recebeu as informações prestadas pelo prescritor.
Art. 5º Todo e qualquer evento adverso relacionado ao uso de medicamento que contenha a substância sibutramina, seus sais e isômeros, bem como intermediários, são de notificação compulsória ao Sistema Nacional de Vigilância Sanitária.
Parágrafo único. A responsabilidade pela notificação cabe aos profissionais de saúde, aos detentores do registro de medicamentos contendo a substância sibutramina, seus sais e isômeros, bem como intermediários e aos estabelecimentos que manipulem ou dispensem esses medicamentos.
Art. 6° As empresas detentoras do registro dos medicamentos à base da substância sibutramina, seus sais e isômeros, bem como intermediários deverão cumprir as normas constantes da Resolução de Diretoria Colegiada - RDC No- 04, de 10 de fevereiro de 2009, que dispõe sobre as normas de farmacovigilância para os detentores de registro de medicamentos de uso humano, e da Instrução Normativa No- 14, de 27 de outubro de 2009, que aprovou os guias técnicos para a elaboração de Planos de Farmacovigilância, de Planos de Minimização de Riscos e do Relatório Periódico.
§ 1º As empresas de que trata o caput terão um prazo de 60 (sessenta) dias, a contar da publicação desta Resolução, para apresentarem à área de farmacovigilância da ANVISA um Plano de Minimização de Risco relacionado ao uso desses medicamentos, prevendo as condições para o monitoramento efetivo da segurança do produto por um período de 12 (doze) meses.
§ 2º A inobservância da exigência prevista no § 1º acarretará o cancelamento do registro do medicamento na ANVISA
.
§ 3º Após a implementação do Plano de Minimização de Risco pelo período de 12 (doze) meses, as empresas responsáveis pelos mesmos deverão apresentar os seus resultados à área de farmacocovigilância da ANVISA, a quem caberá sua análise.
§ 4º Os Relatórios Periódicos dessas empresas deverão ser apresentados a cada 6 (seis) meses, durante o período de vigência do Plano de Minimização de Risco.
Art. 7º Os novos pedidos de registro de medicamentos contendo a substância sibutramina, seus sais e isômeros, bem como intermediários, deverão conter o Plano de Minimização de Risco, a que se refere o art. 6º desta Resolução.
Parágrafo único. As empresas que tem processo em andamento para o registro de medicamentos contendo a substância sibutramina, seus sais e isômeros, bem como intermediários, deverão aditar o Plano de Minimização de Risco, a que se refere o art. 6º desta Resolução.
Art. 8º As farmácias de manipulação deverão apresentar à área de farmacovigilância da ANVISA relatório semestral sobre as notificações de suspeitas de eventos adversos com o uso de sibutramina.
§ 1º A ausência de notificações no período definido no caput não desobriga a apresentação do relatório definido no caput, que deverá conter as justificativas de ausência de notificações.
§ 2º Para o cumprimento no disposto no caput o responsável técnico pela farmácia deverá cadastrar-se no Sistema Nacional de Notificações para a Vigilância Sanitária - NOTIVISA, com acesso disponível no sítio eletrônico da Anvisa na internet, ou no sistema que venha a substituí-lo.
§ 3º A farmácia deverá preencher os campos específicos do Termo de Responsabilidade do Prescritor que acompanha a notificação de receita definida no parágrafo único do art. 2º desta Resolução, reter uma via e entregar a outra via para o paciente
Art. 9º O responsável técnico pela farmácia ou drogaria que dispense apenas medicamentos industrializados contendo a substância sibutramina, seus sais e isômeros, bem como intermediários deverá cadastrar-se no Sistema Nacional de Notificações para a Vigilância Sanitária - NOTIVISA, com acesso disponível no sítio eletrônico da Anvisa na internet, ou no sistema que venha a substituí-lo.
Art. 10 Os profissionais prescritores dos medicamentos contendo a substância sibutramina, seus sais e isômeros, bem como intermediários deverão cadastrar-se no Sistema Nacional de Notificações para a Vigilância Sanitária - NOTIVISA, com acesso disponível no sítio eletrônico da Anvisa na internet, ou no sistema que venha a substituí-lo.
Art. 11 O descumprimento das disposições contidas nesta Resolução constitui infração sanitária, nos termos da Lei No- 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis.
Art. 12. Fica revogada a Resolução de Diretoria Colegiada - RDC No- 25, de 30 de junho de 2010, e os incisos I, III e IV do parágrafo único do artigo 2º da RDC No- 58, de 05 de setembro de 2007.
Art. 13. Esta Resolução entra em vigor no prazo de 60 (sessenta) dias a contar da data de sua publicação.
DIRCEU BRÁS APARECIDO BARBANO
ANEXO I
TERMO DE RESPONSABILIDADE DO PRESCRITOR PARA USO DO MEDICAMENTO CONTENDO A SUBSTÂNCIA SIBUTRAMINA
Eu, Dr.(a) ______________________________________________, registrado no Conselho Regional de Medicina do Estado sob o número ___________________, sou o responsável pelo tratamento e acompanhamento do(a) paciente_________________________________________, do sexo ________________________________________, com idade de ______ anos completos, com diagnóstico de____________, para quem estou indicando o medicamento à base de SIBUTRAMINA.
Informei ao paciente que:
1. O medicamento contendo a substância sibutramina:
a. Foi submetido a um estudo realizado após a aprovação do produto, com 10.744 (dez mil, setecentos e quarenta e quatro) pacientes com sobrepeso ou obesos, com 55 (cinqüenta e cinco) anos de idade ou mais, com alto risco cardiovascular, tratados com sibutramina e observou-se um aumento de 16% (dezesseis por cento) no risco de infarto do miocárdio não fatal, acidente vascular cerebral não fatal, parada cardíaca ou morte cardiovascular comparados com os pacientes que não usaram o medicamento; e
b. Portanto, a utilização do medicamento está restrita às indicações e eficácia descritas no item 2, e respeitando-se rigorosamente as contraindicações descritas no item 3 e as precauções descritas no item 4.
2. As indicações e eficácia dos medicamentos contendo sibutramina estão sujeitas às seguintes restrições:
a. A eficácia do tratamento da obesidade deve ser medida pela perda de peso de pelo menos de 5% (cinco por cento) a 10% (dez por cento) do peso corporal inicial acompanhado da diminuição de parâmetros metabólicos considerados fatores de risco da obesidade; e
b. o medicamento deve ser utilizado como terapia adjuvante, como parte de um programa de gerenciamento de peso para pacientes obesos com índice de massa corpórea (IMC) > ou = a 30 kg/m2 (maior ou igual a trinta quilogramas por metro quadrado), num prazo máximo de 2 (dois) anos, devendo ser acompanhado por um programa de reeducação alimentar e atividade física compatível com as condições do usuário.
3. O uso da sibutramina está contra-indicado em pacientes:
a. Com índice de massa corpórea (IMC) menor que 30 kg/m2 (trinta quilogramas por metro quadrado);
b. Com histórico de diabetes mellitus tipo 2 com pelo menos outro fator de risco (i.e., hipertensão controlada por medicação, dislipidemia, prática atual de tabagismo, nefropatia diabética com evidência de microalbuminúria);
c. Com histórico de doença arterial coronariana (angina, história de infarto do miocárdio), insuficiência cardíaca congestiva, taquicardia, doença arterial obstrutiva periférica, arritmia ou doença cerebrovascular
(acidente vascular cerebral ou ataque isquêmico transitório);
d. Hipertensão controlada inadequadamente, > 145/90 mmHg (maior que cento e quarenta e cinco por noventa milímetros de mercúrio);
e. Com idade acima de 65 (sessenta e cinco) anos, crianças e adolescentes;
f. Com histórico ou presença de transtornos alimentares, como bulimia e anorexia; ou
g. Em uso de outros medicamentos de ação central para redução de peso ou tratamento de transtornos psiquiátricos.
4. As precauções com o uso dos medicamentos à base de sibutramina exigem que:
a. Ocorra a descontinuidade do tratamento em pacientes que não responderem à perda de peso após 4 (quatro) semanas de tratamento com dose diária máxima de 15 mg/dia (quinze miligramas por dia), considerando-se que esta perda deve ser de, pelo menos, 2 kg (dois quilogramas), durante estas 4 (quatro) primeiras semanas; e b. haja a monitorização da pressão arterial e da frequência cardíaca durante todo o tratamento, pois o uso da sibutramina tem como efeito colateral o aumento, de forma relevante, da pressão arterial e da frequência cardíaca, o que pode determinar a descontinuidade do tratamento.
5. O uso da sibutramina no Brasil está em período de monitoramento do seu perfil de segurança, conforme RDC/ANVISA No- XX/ 2011.
6. O paciente deve informar ao médico prescritor toda e qualquer intercorrência clínica durante o uso do medicamento.
7. É responsabilidade de o médico prescritor notificar ao Sistema Nacional de Vigilância Sanitária, por meio do sistema NOTIVISA, as suspeitas de eventos adversos de que tome conhecimento.
8. Para viabilizar e facilitar o contato, disponibilizo ao paciente os seguintes telefones, e-mail, fax, ou outro sistema de contato:
____________________________________________________.
Assinatura e carimbo do (a) médico(a):____________________________ C.R.M.: _________
Data: ____/____/_____
A ser preenchido pelo(a) paciente: Eu, _______________________________________, Carteira de
Identidade No- ____________, Órgão Expedidor _________________, residente na rua ______________________________, Cidade ___________________________, Estado _________, telefone___________________, recebi pessoalmente as informações sobre o tratamento que vou fazer. Entendo que este remédio é só meu e que não devo passá-lo para ninguém.
Assinatura: _____________________________________
Data: ____/____/_____
A ser preenchido pela Farmácia de manipulação no caso de o medicamento ter sido prescrito com indicação de ser manipulado:
Eu, Dr.(a) _______________________________________________, registrado(a) no Conselho Regional de Farmácia do Estado sob o número ___________________, sendo o responsável técnico da Farmácia _______________________________, situada no endereço_______________________,sou responsável pelo aviamento e dispensação do medicamento contendo sibutramina para o paciente_________________.
Informei ao paciente que:
1. Deve informar à farmácia responsável pela manipulação do medicamento relatos de eventos adversos durante o uso do medicamento;e
2. é responsabilidade do responsável técnico da Farmácia notificar ao Sistema Nacional de Vigilância Sanitária, por meio do sistema NOTIVISA, as suspeitas de eventos adversos de que tome conhecimento.
3. Para viabilizar e facilitar o contato, disponibilizo ao paciente os seguintes telefones, e-mail, fax, ou outro sistema de contato:
_____________________________________________________
Assinatura e carimbo do (a) farmacêutico(a):_______________________ C.R.F.: _________
Data: ____/____/_____
Assinatura do (a) paciente:______________________________________________________
Data: ____/____/_____
Fonte: http://www.in.gov.br/imprensa/visualiza/index.jsp?jornal=1&pagina=55&data=10%2F10%2F2011



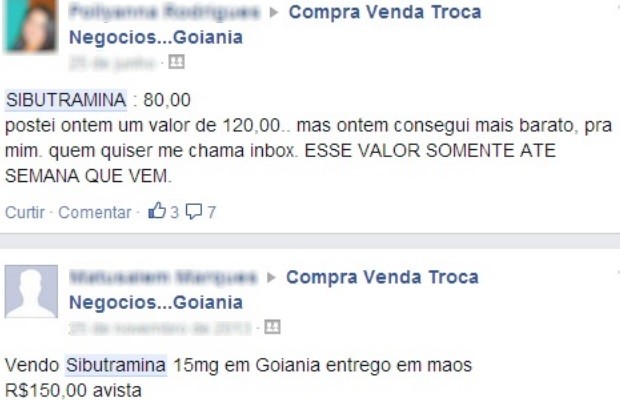

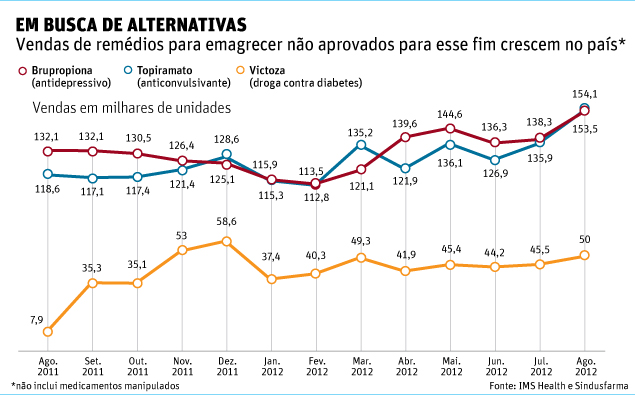



 Anvisa decide banir do mercado emagrecedores à base de anfetaminas, mas mantém derivados de sibutramina
Anvisa decide banir do mercado emagrecedores à base de anfetaminas, mas mantém derivados de sibutramina